Löslichkeit wird in der Chemie verwendet, um die Eigenschaften einer festen Verbindung zu beschreiben, die mit einer Flüssigkeit vermischt ist und sich vollständig darin löst, ohne irgendwelche ungelösten Partikel zu hinterlassen. Nur ionische (geladene) Verbindungen sind löslich. Für praktische Zwecke reicht es aus, einige Regeln zu merken oder sich auf eine Liste von ihnen zu beziehen, um zu sagen, ob die meisten ionischen Verbindungen fest bleiben, wenn sie in Wasser fallen, oder ob eine signifikante Menge sich auflöst. In Wirklichkeit wird sich eine gewisse Anzahl von Molekülen auflösen, selbst wenn Sie die Veränderung nicht sehen können. Für genaue Experimente müssen Sie vielleicht wissen, wie man diese Menge berechnet.
Methode eins von zwei:
Verwenden von Schnellregeln
-
 1 Erfahren Sie mehr über ionische Verbindungen. Jedes Atom hat normalerweise eine bestimmte Anzahl von Elektronen, aber manchmal nehmen sie ein zusätzliches Elektron auf oder verlieren eins durch einen Prozess, der als Elektronentransfer bekannt ist.[1] Das Ergebnis ist ein Ion, die eine elektrische Ladung hat. Wenn ein Ion mit einer negativen Ladung (ein zusätzliches Elektron) auf ein Ion mit einer positiven Ladung trifft (ein Elektron fehlt), verbinden sie sich genau wie die negativen und positiven Enden von 2 Magneten. Das Ergebnis ist eine ionische Verbindung.
1 Erfahren Sie mehr über ionische Verbindungen. Jedes Atom hat normalerweise eine bestimmte Anzahl von Elektronen, aber manchmal nehmen sie ein zusätzliches Elektron auf oder verlieren eins durch einen Prozess, der als Elektronentransfer bekannt ist.[1] Das Ergebnis ist ein Ion, die eine elektrische Ladung hat. Wenn ein Ion mit einer negativen Ladung (ein zusätzliches Elektron) auf ein Ion mit einer positiven Ladung trifft (ein Elektron fehlt), verbinden sie sich genau wie die negativen und positiven Enden von 2 Magneten. Das Ergebnis ist eine ionische Verbindung. - Ionen mit negativen Ladungen werden genannt Anionen, während Ionen mit positiven Ladungen sind Kationen.
- Normalerweise ist die Anzahl der Elektronen in einem Atom gleich der Anzahl der Protonen und hebt die elektrischen Ladungen auf.
-
 2 Löslichkeit verstehen. Wassermoleküle (H2O) haben eine ungewöhnliche Struktur, die sie einem Magneten ähnlich macht: ein Ende hat eine positive Ladung, während das andere ein Negativ hat. Wenn Sie eine ionische Verbindung in Wasser fallen lassen, sammeln sich diese "Wassermagneten" um sie herum und versuchen, die positiven und negativen Ionen auseinander zu ziehen.[2]
2 Löslichkeit verstehen. Wassermoleküle (H2O) haben eine ungewöhnliche Struktur, die sie einem Magneten ähnlich macht: ein Ende hat eine positive Ladung, während das andere ein Negativ hat. Wenn Sie eine ionische Verbindung in Wasser fallen lassen, sammeln sich diese "Wassermagneten" um sie herum und versuchen, die positiven und negativen Ionen auseinander zu ziehen.[2] - Einige ionische Verbindungen haften nicht sehr gut zusammen; diese sind löslich denn das Wasser wird sie auseinanderziehen und auflösen. Andere Verbindungen sind stärker gebunden und sind unlöslich da sie trotz der Wassermoleküle zusammenkleben können.
- Einige Verbindungen haben innere Bindungen, die in der Stärke der Wasserzugabe ähnlich sind. Diese nennt man schwach löslich, da eine erhebliche Menge an Verbindungen auseinander gezogen wird, aber der Rest wird zusammen bleiben.
-
 3 Studiere die Regeln der Löslichkeit. Da die Wechselwirkungen zwischen Atomen sehr komplex sind, ist es nicht immer intuitiv, welche Verbindungen löslich und welche unlöslich sind. Suche das erste Ion in der Verbindung in der Liste unten, um herauszufinden, wie es sich normalerweise verhält, und überprüfe dann die Ausnahmen, um sicherzustellen, dass das zweite Ion keine ungewöhnliche Wechselwirkung hat.
3 Studiere die Regeln der Löslichkeit. Da die Wechselwirkungen zwischen Atomen sehr komplex sind, ist es nicht immer intuitiv, welche Verbindungen löslich und welche unlöslich sind. Suche das erste Ion in der Verbindung in der Liste unten, um herauszufinden, wie es sich normalerweise verhält, und überprüfe dann die Ausnahmen, um sicherzustellen, dass das zweite Ion keine ungewöhnliche Wechselwirkung hat. - Zum Beispiel, um Strontiumchlorid (SrCl2), suchen Sie in den folgenden fett gedruckten Schritten nach Sr oder Cl. Cl ist "normalerweise löslich", also prüfen Sie darunter nach Ausnahmen. Sr ist nicht als Ausnahme aufgeführt, also SrCl2 muss löslich sein.
- Die häufigsten Ausnahmen für jede Regel sind darunter geschrieben. Es gibt andere Ausnahmen, aber Sie werden sie wahrscheinlich nicht in einem typischen Chemieunterricht oder Laboratorium begegnen.
-
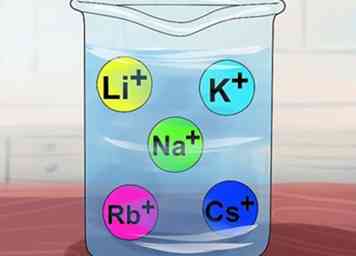 4 Erkenne, dass Verbindungen löslich sind, wenn sie Alkalimetalle enthalten. Alkalimetalle umfassen Li+, N / a+, K+, Rb+und Cs+. Diese werden auch als Elemente der Gruppe IA bezeichnet: Lithium, Natrium, Kalium, Rubidium und Cäsium. Fast jede einzelne Verbindung, die eines dieser Ionen enthält, ist löslich.
4 Erkenne, dass Verbindungen löslich sind, wenn sie Alkalimetalle enthalten. Alkalimetalle umfassen Li+, N / a+, K+, Rb+und Cs+. Diese werden auch als Elemente der Gruppe IA bezeichnet: Lithium, Natrium, Kalium, Rubidium und Cäsium. Fast jede einzelne Verbindung, die eines dieser Ionen enthält, ist löslich. - Ausnahme: Li3PO4 ist unlöslich.
-
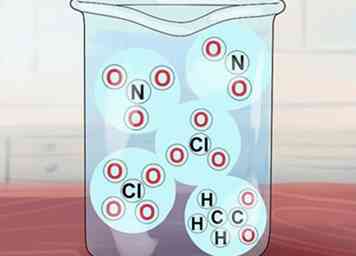 5 Verstehe, dass einige andere Verbindungen löslich sind. Diese umfassen Verbindungen von NO3-, C2H3O2-, NEIN2-, ClO3-und ClO4-. Dies sind jeweils die Nitrat-, Acetat-, Nitrit-, Chlorat- und Perchlorationen. Beachten Sie, dass Acetat oft als OAC abgekürzt wird.[3]
5 Verstehe, dass einige andere Verbindungen löslich sind. Diese umfassen Verbindungen von NO3-, C2H3O2-, NEIN2-, ClO3-und ClO4-. Dies sind jeweils die Nitrat-, Acetat-, Nitrit-, Chlorat- und Perchlorationen. Beachten Sie, dass Acetat oft als OAC abgekürzt wird.[3] - Ausnahmen: Ag (OAc) (Silberacetat) und Hg (OAc)2 (Quecksilberacetat) sind unlöslich.
- AgNO2- und KClO4- sind nur "leicht löslich".
-
 6 Beachten Sie, dass Verbindungen von Cl-, Br-, und ich- sind normalerweise löslich. Die Chlorid-, Bromid- und Jodidionen machen fast immer lösliche Verbindungen, Halogensalze genannt.
6 Beachten Sie, dass Verbindungen von Cl-, Br-, und ich- sind normalerweise löslich. Die Chlorid-, Bromid- und Jodidionen machen fast immer lösliche Verbindungen, Halogensalze genannt. - Ausnahme: Wenn eines dieser Paare mit den Ionen Silber Ag+, Quecksilber Hg22+oder Blei Pb2+Das Ergebnis ist unlösbar. Dasselbe gilt für weniger gebräuchliche Verbindungen, die aus der Paarung mit Kupfer-Cu hergestellt werden+ und Thallium Tl+.
-
 7 Erkenne, dass Verbindungen, die SO enthalten42- sind normalerweise löslich. Das Sulfation bildet im Allgemeinen lösliche Verbindungen, aber es gibt einige Ausnahmen.
7 Erkenne, dass Verbindungen, die SO enthalten42- sind normalerweise löslich. Das Sulfation bildet im Allgemeinen lösliche Verbindungen, aber es gibt einige Ausnahmen. - Ausnahmen: Das Sulfation bildet unlösliche Verbindungen mit den folgenden Ionen: Strontium Sr2+, Barium Ba2+, führen Pb2+, Silber Ag+, Kalzium Ca2+, Radium Ra2+und zweiatomiges Silber Ag22+. Beachten Sie, dass sich Silbersulfat und Calciumsulfat gerade so weit auflösen, dass einige Menschen sie als leicht löslich bezeichnen.
-
 8 Wissen, dass Verbindungen OH enthalten- oder S2- sind unlöslich. Dies sind die Hydroxid- bzw. Sulfidionen.
8 Wissen, dass Verbindungen OH enthalten- oder S2- sind unlöslich. Dies sind die Hydroxid- bzw. Sulfidionen. - Ausnahmen: Erinnern Sie sich an die Alkalimetalle (Gruppe I-A) und wie sie es lieben, lösliche Verbindungen zu bilden? Li+, N / a+, K+, Rb+und Cs+ alle bilden lösliche Verbindungen mit den Hydroxid- oder Sulfidionen. Zusätzlich bildet Hydroxid lösliche Salze mit den Erdalkalimetallionen (Gruppe II-A): Calcium Ca2+, Strontium Sr2+und Barium Ba2+. Man beachte, dass die Verbindungen, die aus Hydroxid und einer Erdalkalimetalle resultieren, gerade genug Moleküle haben, die gebunden bleiben, um manchmal als "leicht löslich" betrachtet zu werden.
-
 9 Verstehe, dass Verbindungen, die CO enthalten32- oder PO43- sind unlöslich. Eine letzte Überprüfung auf Karbonat- und Phosphationen, und Sie sollten wissen, was Sie von Ihrer Verbindung erwarten können.
9 Verstehe, dass Verbindungen, die CO enthalten32- oder PO43- sind unlöslich. Eine letzte Überprüfung auf Karbonat- und Phosphationen, und Sie sollten wissen, was Sie von Ihrer Verbindung erwarten können. - Ausnahmen: Diese Ionen bilden lösliche Verbindungen mit den üblichen Verdächtigen, den Alkalimetallen Li+, N / a+, K+, Rb+und Cs+sowie mit Ammonium NH4+.
Methode zwei von zwei:
Berechnung der Löslichkeit aus der Ksp
-
 1 Nachschlagen der Produktlöslichkeitskonstante (Ksp). Diese Konstante ist für jede Verbindung unterschiedlich, daher müssen Sie sie in einem Diagramm in Ihrem Lehrbuch nachschlagen. Da diese Werte experimentell ermittelt werden, können sie in den Diagrammen sehr unterschiedlich sein. Daher empfiehlt es sich, das Diagramm des Lehrbuchs zu verwenden, wenn es ein Diagramm enthält. Wenn nicht anders angegeben, gehen die meisten Diagramme davon aus, dass Sie bei 25 ° C arbeiten.
1 Nachschlagen der Produktlöslichkeitskonstante (Ksp). Diese Konstante ist für jede Verbindung unterschiedlich, daher müssen Sie sie in einem Diagramm in Ihrem Lehrbuch nachschlagen. Da diese Werte experimentell ermittelt werden, können sie in den Diagrammen sehr unterschiedlich sein. Daher empfiehlt es sich, das Diagramm des Lehrbuchs zu verwenden, wenn es ein Diagramm enthält. Wenn nicht anders angegeben, gehen die meisten Diagramme davon aus, dass Sie bei 25 ° C arbeiten. - Zum Beispiel, wenn Sie Bleiiodid oder PbI auflösen2Notieren Sie die Produktlöslichkeitskonstante.
-
 2 Schreibe die chemische Gleichung. Bestimmen Sie zunächst, wie sich die Verbindung bei Auflösung in Ionen aufspaltet. Schreiben Sie als nächstes eine Gleichung mit dem Ksp auf der einen Seite und die konstituierenden Ionen auf der anderen Seite.
2 Schreibe die chemische Gleichung. Bestimmen Sie zunächst, wie sich die Verbindung bei Auflösung in Ionen aufspaltet. Schreiben Sie als nächstes eine Gleichung mit dem Ksp auf der einen Seite und die konstituierenden Ionen auf der anderen Seite. - Zum Beispiel ein Molekül PbI2 spaltet sich in die Ionen Pb2+, ICH-und ein zweites Ich-. (Sie müssen nur die Ladung von 1 Ion kennen oder nachschlagen, da Sie wissen, dass die gesamte Verbindung immer eine neutrale Ladung hat.)
- Schreibe die Gleichung 7.1 × 10-9 = [Pb2+][ICH-]2
- Die Gleichung ist die Produktlöslichkeitskonstante, die für die 2 Ionen in einem Löslichkeitsdiagramm gefunden werden kann. Da sind 2 Ich- Ionen, ich- ist die zweite Macht.
-
 3 Ändern Sie die Gleichung, um Variablen zu verwenden. Schreiben Sie die Gleichung als einfaches Algebra-Problem um, indem Sie das verwenden, was Sie über die Anzahl der Moleküle und Ionen wissen. Setze x gleich der Menge der Verbindung, die sich auflöst, und überschreibe die Variablen, die die Zahlen jedes Ions in x darstellen.
3 Ändern Sie die Gleichung, um Variablen zu verwenden. Schreiben Sie die Gleichung als einfaches Algebra-Problem um, indem Sie das verwenden, was Sie über die Anzahl der Moleküle und Ionen wissen. Setze x gleich der Menge der Verbindung, die sich auflöst, und überschreibe die Variablen, die die Zahlen jedes Ions in x darstellen. - In unserem Beispiel müssen wir 7.1 × 10 umschreiben-9 = [Pb2+][ICH-]2
- Da 1 Bleiion (Pb2+) In der Verbindung ist die Anzahl der gelösten Verbindungsmoleküle gleich der Anzahl der freien Bleiionen. So können wir [Pb2+] bis x.
- Da es 2 Jodionen gibt (I-) Für jedes Bleiion können wir die Anzahl der Iodatome auf 2 x 2 einstellen.
- Die Gleichung ist jetzt 7.1 × 10-9 = (x) (2x)2
-
 4 Gegebenenfalls vorhandene Ionen berücksichtigen. Überspringen Sie diesen Schritt, wenn Sie die Verbindung in reinem Wasser auflösen. Wenn die Verbindung in eine Lösung aufgelöst wird, die bereits einen oder mehrere der konstituierenden Ionen enthält (ein "gemeinsames Ion"), wird die Löslichkeit jedoch signifikant verringert.[4] Der allgemeine Ioneneffekt ist am bemerkenswertesten in Verbindungen, die meistens unlöslich sind, und in diesen Fällen kann man annehmen, dass die überwiegende Mehrheit der Ionen im Gleichgewicht von dem bereits in der Lösung vorhandenen Ion stammt. Schreiben Sie die Gleichung so um, dass sie die bekannte molare Konzentration (Mol pro Liter oder M) der bereits in der Lösung vorhandenen Ionen enthält und den Wert von x ersetzt, den Sie für dieses Ion verwendet haben.[5]
4 Gegebenenfalls vorhandene Ionen berücksichtigen. Überspringen Sie diesen Schritt, wenn Sie die Verbindung in reinem Wasser auflösen. Wenn die Verbindung in eine Lösung aufgelöst wird, die bereits einen oder mehrere der konstituierenden Ionen enthält (ein "gemeinsames Ion"), wird die Löslichkeit jedoch signifikant verringert.[4] Der allgemeine Ioneneffekt ist am bemerkenswertesten in Verbindungen, die meistens unlöslich sind, und in diesen Fällen kann man annehmen, dass die überwiegende Mehrheit der Ionen im Gleichgewicht von dem bereits in der Lösung vorhandenen Ion stammt. Schreiben Sie die Gleichung so um, dass sie die bekannte molare Konzentration (Mol pro Liter oder M) der bereits in der Lösung vorhandenen Ionen enthält und den Wert von x ersetzt, den Sie für dieses Ion verwendet haben.[5] - Zum Beispiel, wenn unsere Bleiiodidverbindung in einer Lösung mit 0,2 M Bleichlorid (PbCl2), würden wir unsere Gleichung als 7.1 × 10 umschreiben-9 = (0,2M + x) (2x)2. Da 0,2 M eine höhere Konzentration als x ist, können wir es sicher als 7.1 × 10 umschreiben-9 = (0,2 M) (2x)2.
-
 5 Löse die Gleichung. Löse für x, und du wirst wissen, wie löslich die Verbindung ist. Aufgrund der Definition der Löslichkeitskonstante wird Ihre Antwort in Molen der gelösten Verbindung pro Liter Wasser angegeben. Möglicherweise benötigen Sie einen Taschenrechner, um die endgültige Antwort zu finden.
5 Löse die Gleichung. Löse für x, und du wirst wissen, wie löslich die Verbindung ist. Aufgrund der Definition der Löslichkeitskonstante wird Ihre Antwort in Molen der gelösten Verbindung pro Liter Wasser angegeben. Möglicherweise benötigen Sie einen Taschenrechner, um die endgültige Antwort zu finden. - Das Folgende ist für die Löslichkeit in reinem Wasser, nicht mit irgendwelchen üblichen Ionen.
- 7.1×10-9 = (x) (2x)2
- 7.1×10-9 = (x) (4x2)
- 7.1×10-9 = 4x3
- (7.1×10-9) ÷ 4 = x3
- x = ∞ ((7.1 × 10-9) ÷ 4)
- x = 1,2 x 10-3 Mole pro Liter lösen sich auf. Dies ist eine sehr kleine Menge, daher wissen Sie, dass diese Verbindung im Wesentlichen unlöslich ist.
 Minotauromaquia
Minotauromaquia
 1 Erfahren Sie mehr über ionische Verbindungen. Jedes Atom hat normalerweise eine bestimmte Anzahl von Elektronen, aber manchmal nehmen sie ein zusätzliches Elektron auf oder verlieren eins durch einen Prozess, der als Elektronentransfer bekannt ist.[1] Das Ergebnis ist ein Ion, die eine elektrische Ladung hat. Wenn ein Ion mit einer negativen Ladung (ein zusätzliches Elektron) auf ein Ion mit einer positiven Ladung trifft (ein Elektron fehlt), verbinden sie sich genau wie die negativen und positiven Enden von 2 Magneten. Das Ergebnis ist eine ionische Verbindung.
1 Erfahren Sie mehr über ionische Verbindungen. Jedes Atom hat normalerweise eine bestimmte Anzahl von Elektronen, aber manchmal nehmen sie ein zusätzliches Elektron auf oder verlieren eins durch einen Prozess, der als Elektronentransfer bekannt ist.[1] Das Ergebnis ist ein Ion, die eine elektrische Ladung hat. Wenn ein Ion mit einer negativen Ladung (ein zusätzliches Elektron) auf ein Ion mit einer positiven Ladung trifft (ein Elektron fehlt), verbinden sie sich genau wie die negativen und positiven Enden von 2 Magneten. Das Ergebnis ist eine ionische Verbindung.  2 Löslichkeit verstehen. Wassermoleküle (H2O) haben eine ungewöhnliche Struktur, die sie einem Magneten ähnlich macht: ein Ende hat eine positive Ladung, während das andere ein Negativ hat. Wenn Sie eine ionische Verbindung in Wasser fallen lassen, sammeln sich diese "Wassermagneten" um sie herum und versuchen, die positiven und negativen Ionen auseinander zu ziehen.[2]
2 Löslichkeit verstehen. Wassermoleküle (H2O) haben eine ungewöhnliche Struktur, die sie einem Magneten ähnlich macht: ein Ende hat eine positive Ladung, während das andere ein Negativ hat. Wenn Sie eine ionische Verbindung in Wasser fallen lassen, sammeln sich diese "Wassermagneten" um sie herum und versuchen, die positiven und negativen Ionen auseinander zu ziehen.[2]  3 Studiere die Regeln der Löslichkeit. Da die Wechselwirkungen zwischen Atomen sehr komplex sind, ist es nicht immer intuitiv, welche Verbindungen löslich und welche unlöslich sind. Suche das erste Ion in der Verbindung in der Liste unten, um herauszufinden, wie es sich normalerweise verhält, und überprüfe dann die Ausnahmen, um sicherzustellen, dass das zweite Ion keine ungewöhnliche Wechselwirkung hat.
3 Studiere die Regeln der Löslichkeit. Da die Wechselwirkungen zwischen Atomen sehr komplex sind, ist es nicht immer intuitiv, welche Verbindungen löslich und welche unlöslich sind. Suche das erste Ion in der Verbindung in der Liste unten, um herauszufinden, wie es sich normalerweise verhält, und überprüfe dann die Ausnahmen, um sicherzustellen, dass das zweite Ion keine ungewöhnliche Wechselwirkung hat.  4 Erkenne, dass Verbindungen löslich sind, wenn sie Alkalimetalle enthalten. Alkalimetalle umfassen Li+, N / a+, K+, Rb+und Cs+. Diese werden auch als Elemente der Gruppe IA bezeichnet: Lithium, Natrium, Kalium, Rubidium und Cäsium. Fast jede einzelne Verbindung, die eines dieser Ionen enthält, ist löslich.
4 Erkenne, dass Verbindungen löslich sind, wenn sie Alkalimetalle enthalten. Alkalimetalle umfassen Li+, N / a+, K+, Rb+und Cs+. Diese werden auch als Elemente der Gruppe IA bezeichnet: Lithium, Natrium, Kalium, Rubidium und Cäsium. Fast jede einzelne Verbindung, die eines dieser Ionen enthält, ist löslich.  5 Verstehe, dass einige andere Verbindungen löslich sind. Diese umfassen Verbindungen von NO3-, C2H3O2-, NEIN2-, ClO3-und ClO4-. Dies sind jeweils die Nitrat-, Acetat-, Nitrit-, Chlorat- und Perchlorationen. Beachten Sie, dass Acetat oft als OAC abgekürzt wird.[3]
5 Verstehe, dass einige andere Verbindungen löslich sind. Diese umfassen Verbindungen von NO3-, C2H3O2-, NEIN2-, ClO3-und ClO4-. Dies sind jeweils die Nitrat-, Acetat-, Nitrit-, Chlorat- und Perchlorationen. Beachten Sie, dass Acetat oft als OAC abgekürzt wird.[3]  6 Beachten Sie, dass Verbindungen von Cl-, Br-, und ich- sind normalerweise löslich. Die Chlorid-, Bromid- und Jodidionen machen fast immer lösliche Verbindungen, Halogensalze genannt.
6 Beachten Sie, dass Verbindungen von Cl-, Br-, und ich- sind normalerweise löslich. Die Chlorid-, Bromid- und Jodidionen machen fast immer lösliche Verbindungen, Halogensalze genannt.  7 Erkenne, dass Verbindungen, die SO enthalten42- sind normalerweise löslich. Das Sulfation bildet im Allgemeinen lösliche Verbindungen, aber es gibt einige Ausnahmen.
7 Erkenne, dass Verbindungen, die SO enthalten42- sind normalerweise löslich. Das Sulfation bildet im Allgemeinen lösliche Verbindungen, aber es gibt einige Ausnahmen.  8 Wissen, dass Verbindungen OH enthalten- oder S2- sind unlöslich. Dies sind die Hydroxid- bzw. Sulfidionen.
8 Wissen, dass Verbindungen OH enthalten- oder S2- sind unlöslich. Dies sind die Hydroxid- bzw. Sulfidionen.  9 Verstehe, dass Verbindungen, die CO enthalten32- oder PO43- sind unlöslich. Eine letzte Überprüfung auf Karbonat- und Phosphationen, und Sie sollten wissen, was Sie von Ihrer Verbindung erwarten können.
9 Verstehe, dass Verbindungen, die CO enthalten32- oder PO43- sind unlöslich. Eine letzte Überprüfung auf Karbonat- und Phosphationen, und Sie sollten wissen, was Sie von Ihrer Verbindung erwarten können.  1 Nachschlagen der Produktlöslichkeitskonstante (Ksp). Diese Konstante ist für jede Verbindung unterschiedlich, daher müssen Sie sie in einem Diagramm in Ihrem Lehrbuch nachschlagen. Da diese Werte experimentell ermittelt werden, können sie in den Diagrammen sehr unterschiedlich sein. Daher empfiehlt es sich, das Diagramm des Lehrbuchs zu verwenden, wenn es ein Diagramm enthält. Wenn nicht anders angegeben, gehen die meisten Diagramme davon aus, dass Sie bei 25 ° C arbeiten.
1 Nachschlagen der Produktlöslichkeitskonstante (Ksp). Diese Konstante ist für jede Verbindung unterschiedlich, daher müssen Sie sie in einem Diagramm in Ihrem Lehrbuch nachschlagen. Da diese Werte experimentell ermittelt werden, können sie in den Diagrammen sehr unterschiedlich sein. Daher empfiehlt es sich, das Diagramm des Lehrbuchs zu verwenden, wenn es ein Diagramm enthält. Wenn nicht anders angegeben, gehen die meisten Diagramme davon aus, dass Sie bei 25 ° C arbeiten.  2 Schreibe die chemische Gleichung. Bestimmen Sie zunächst, wie sich die Verbindung bei Auflösung in Ionen aufspaltet. Schreiben Sie als nächstes eine Gleichung mit dem Ksp auf der einen Seite und die konstituierenden Ionen auf der anderen Seite.
2 Schreibe die chemische Gleichung. Bestimmen Sie zunächst, wie sich die Verbindung bei Auflösung in Ionen aufspaltet. Schreiben Sie als nächstes eine Gleichung mit dem Ksp auf der einen Seite und die konstituierenden Ionen auf der anderen Seite.  3 Ändern Sie die Gleichung, um Variablen zu verwenden. Schreiben Sie die Gleichung als einfaches Algebra-Problem um, indem Sie das verwenden, was Sie über die Anzahl der Moleküle und Ionen wissen. Setze x gleich der Menge der Verbindung, die sich auflöst, und überschreibe die Variablen, die die Zahlen jedes Ions in x darstellen.
3 Ändern Sie die Gleichung, um Variablen zu verwenden. Schreiben Sie die Gleichung als einfaches Algebra-Problem um, indem Sie das verwenden, was Sie über die Anzahl der Moleküle und Ionen wissen. Setze x gleich der Menge der Verbindung, die sich auflöst, und überschreibe die Variablen, die die Zahlen jedes Ions in x darstellen.  4 Gegebenenfalls vorhandene Ionen berücksichtigen. Überspringen Sie diesen Schritt, wenn Sie die Verbindung in reinem Wasser auflösen. Wenn die Verbindung in eine Lösung aufgelöst wird, die bereits einen oder mehrere der konstituierenden Ionen enthält (ein "gemeinsames Ion"), wird die Löslichkeit jedoch signifikant verringert.[4] Der allgemeine Ioneneffekt ist am bemerkenswertesten in Verbindungen, die meistens unlöslich sind, und in diesen Fällen kann man annehmen, dass die überwiegende Mehrheit der Ionen im Gleichgewicht von dem bereits in der Lösung vorhandenen Ion stammt. Schreiben Sie die Gleichung so um, dass sie die bekannte molare Konzentration (Mol pro Liter oder M) der bereits in der Lösung vorhandenen Ionen enthält und den Wert von x ersetzt, den Sie für dieses Ion verwendet haben.[5]
4 Gegebenenfalls vorhandene Ionen berücksichtigen. Überspringen Sie diesen Schritt, wenn Sie die Verbindung in reinem Wasser auflösen. Wenn die Verbindung in eine Lösung aufgelöst wird, die bereits einen oder mehrere der konstituierenden Ionen enthält (ein "gemeinsames Ion"), wird die Löslichkeit jedoch signifikant verringert.[4] Der allgemeine Ioneneffekt ist am bemerkenswertesten in Verbindungen, die meistens unlöslich sind, und in diesen Fällen kann man annehmen, dass die überwiegende Mehrheit der Ionen im Gleichgewicht von dem bereits in der Lösung vorhandenen Ion stammt. Schreiben Sie die Gleichung so um, dass sie die bekannte molare Konzentration (Mol pro Liter oder M) der bereits in der Lösung vorhandenen Ionen enthält und den Wert von x ersetzt, den Sie für dieses Ion verwendet haben.[5]  5 Löse die Gleichung. Löse für x, und du wirst wissen, wie löslich die Verbindung ist. Aufgrund der Definition der Löslichkeitskonstante wird Ihre Antwort in Molen der gelösten Verbindung pro Liter Wasser angegeben. Möglicherweise benötigen Sie einen Taschenrechner, um die endgültige Antwort zu finden.
5 Löse die Gleichung. Löse für x, und du wirst wissen, wie löslich die Verbindung ist. Aufgrund der Definition der Löslichkeitskonstante wird Ihre Antwort in Molen der gelösten Verbindung pro Liter Wasser angegeben. Möglicherweise benötigen Sie einen Taschenrechner, um die endgültige Antwort zu finden.