Die empirische Formel einer Verbindung ist der einfachste schriftliche Ausdruck ihrer elementaren Zusammensetzung. Sie sollten in der Lage sein, die empirische Formel für jede Verbindung zu bestimmen, solange Sie die Masse jedes vorhandenen Elements, den Prozentsatz der Masse für jedes vorhandene Element oder die Molekülformel der Verbindung kennen.
Methode eins von dreien:
Methode eins: Verwenden von Gewichtsprozenten [1]
-
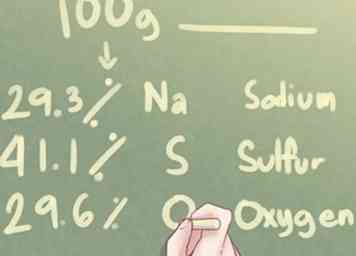 1 Schau dir die Daten an. Wenn Sie die Elementzusammensetzung einer unbekannten Verbindung in Prozent und nicht in Gramm angeben, sollten Sie davon ausgehen, dass genau 100,0 Gramm der Substanz beteiligt sind.
1 Schau dir die Daten an. Wenn Sie die Elementzusammensetzung einer unbekannten Verbindung in Prozent und nicht in Gramm angeben, sollten Sie davon ausgehen, dass genau 100,0 Gramm der Substanz beteiligt sind. - Dies sind die Anweisungen, denen Sie folgen sollten, wenn das Obige wahr ist. Wenn Sie die elementare Zusammensetzung einer unbekannten Substanz in Gramm erhalten, lesen Sie den Abschnitt "Verwenden von Gewicht in Gramm".
- Beispiel: Bestimmen Sie die empirische Formel einer Verbindung aus 29,3% Na (Natrium), 41,1% S (Schwefel) und 29,6% O (Sauerstoff).
-
 2 Bestimmen Sie die Anzahl der Gramm für jedes Element. Basierend auf der Annahme, dass 100 Gramm der unbekannten Substanz vorhanden sind, können Sie feststellen, dass die Anzahl der vorhandenen Gramm für jedes Element dem prozentualen Wert jedes Elements entspricht, das in dem Problem erwähnt wird.
2 Bestimmen Sie die Anzahl der Gramm für jedes Element. Basierend auf der Annahme, dass 100 Gramm der unbekannten Substanz vorhanden sind, können Sie feststellen, dass die Anzahl der vorhandenen Gramm für jedes Element dem prozentualen Wert jedes Elements entspricht, das in dem Problem erwähnt wird. - Beispiel: Für 100 g unbekannte Substanz sind 29,3 g Na, 41,1 g S und 29,6 g O.
-
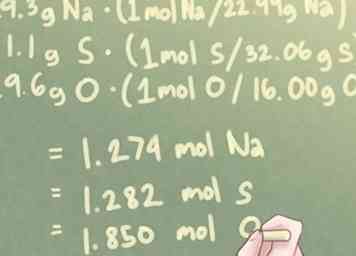 3 Wandle die Masse jedes Elements in Mol um. Die Masse jedes Elements in Ihrer Zusammensetzung, die gegenwärtig in Gramm ausgedrückt wird, muss in Mole umgewandelt werden. Dazu muss jede Masse mit dem Molverhältnis ihrer jeweiligen Atomgewichte multipliziert werden.
3 Wandle die Masse jedes Elements in Mol um. Die Masse jedes Elements in Ihrer Zusammensetzung, die gegenwärtig in Gramm ausgedrückt wird, muss in Mole umgewandelt werden. Dazu muss jede Masse mit dem Molverhältnis ihrer jeweiligen Atomgewichte multipliziert werden. - Vereinfacht ausgedrückt müssen Sie jede Masse durch das Atomgewicht dieses Elements dividieren.
- Beachten Sie auch, dass die in dieser Berechnung verwendeten Atomgewichte mindestens vier signifikante Zahlen enthalten sollten.
- Beispiel: Für eine Verbindung mit 29,3 g Na, 41,1 g S und 29,6 g O:
- 29,3 g Na * (1 Mol S / 22,99 g Na) = 1,274 Mol Na
- 41,1 g S * (1 mol S / 32,06 g S) = 1,282 mol S
- 29,6 g O * (1 mol O / 16,00 g O) = 1,850 mol O
-
 4 Teilen Sie jeden Molwert durch die kleinste Anzahl vorhandener Mole. Du wirst ein brauchen stöchiometrisch Vergleich zwischen den Elementen in Ihrer Verbindung, was im Wesentlichen bedeutet, dass Sie berechnen müssen, wie viel eines Elements Sie in Bezug auf die anderen Elemente in Ihrer Verbindung haben. Um dies zu tun, dividiere jede Anzahl von Molen durch die kleinste Anzahl von vorhandenen Molen.
4 Teilen Sie jeden Molwert durch die kleinste Anzahl vorhandener Mole. Du wirst ein brauchen stöchiometrisch Vergleich zwischen den Elementen in Ihrer Verbindung, was im Wesentlichen bedeutet, dass Sie berechnen müssen, wie viel eines Elements Sie in Bezug auf die anderen Elemente in Ihrer Verbindung haben. Um dies zu tun, dividiere jede Anzahl von Molen durch die kleinste Anzahl von vorhandenen Molen. - Beispiel: Die kleinste Anzahl von Molen, die in der Verbindung vorhanden sind, beträgt 1,274 Mol (die Molzahl für Na, Natrium).
- 1,274 mol Na / 1,274 mol = 1,000 Na
- 1,282 mol S / 1,274 mol = 1,006 S
- 1,850 mol O / 1,274 mol = 1,452 O
- Beispiel: Die kleinste Anzahl von Molen, die in der Verbindung vorhanden sind, beträgt 1,274 Mol (die Molzahl für Na, Natrium).
-
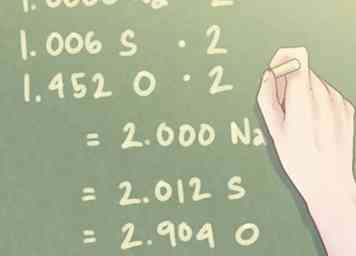 5 Multiplizieren Sie die Verhältniswerte, um fast ganze Zahlen zu finden. Die Menge an Molen, die für jedes Element vorhanden ist, kann nicht ganzzahlig sein. Für kleine Werte, die innerhalb eines zehnten Werts von einer ganzen Zahl entfernt sind, ist dies kein Problem. Wenn Sie jedoch einen Überschuß haben, der diesen Betrag übersteigt, sollten Sie die Verhältniswerte nach Bedarf multiplizieren, um diesen Wert auf eine ganze Zahl zu erhöhen.
5 Multiplizieren Sie die Verhältniswerte, um fast ganze Zahlen zu finden. Die Menge an Molen, die für jedes Element vorhanden ist, kann nicht ganzzahlig sein. Für kleine Werte, die innerhalb eines zehnten Werts von einer ganzen Zahl entfernt sind, ist dies kein Problem. Wenn Sie jedoch einen Überschuß haben, der diesen Betrag übersteigt, sollten Sie die Verhältniswerte nach Bedarf multiplizieren, um diesen Wert auf eine ganze Zahl zu erhöhen. - Wenn ein Element einen Wert nahe 0,5 hat, multiplizieren Sie jedes Element mit 2. Wenn ein Element einen Wert nahe 0,25 hat, multiplizieren Sie jedes Element mit 4.
- Beispiel: Da die Menge an vorhandenem Sauerstoff (O) nahe bei 1,5 liegt, müssen Sie jeden Wert mit "2" multiplizieren, um das Verhältnis von Sauerstoff näher zu einer ganzen Zahl zu bringen.
- 1.000 Na * 2 = 2.000 Na
- 1.006 S * 2 = 2.012 S
- 1.452 O * 2 = 2.904 O
-
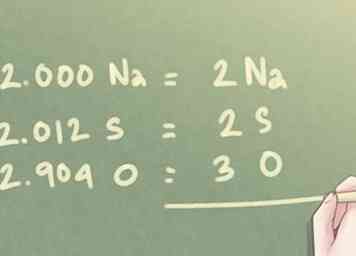 6 Runden Sie die Werte auf die nächsten ganzen Zahlen ab. Selbst nach dem letzten Schritt kann die Menge an Molen, die für jedes Element vorhanden sind, nicht in genauen ganzen Zahlen sein. Da in empirischen Formeln keine Dezimalstellen verwendet werden, müssen Sie jeden Wert auf die nächste ganze Zahl runden.
6 Runden Sie die Werte auf die nächsten ganzen Zahlen ab. Selbst nach dem letzten Schritt kann die Menge an Molen, die für jedes Element vorhanden sind, nicht in genauen ganzen Zahlen sein. Da in empirischen Formeln keine Dezimalstellen verwendet werden, müssen Sie jeden Wert auf die nächste ganze Zahl runden. - Beispiel: Für das im vorherigen Schritt bestimmte Verhältnis:
- 2.000 Na kann als 2 Na geschrieben werden.
- 2.012 S kann auf 2 S abgerundet werden.
- 2.904 O kann auf 3 O aufgerundet werden.
- Beispiel: Für das im vorherigen Schritt bestimmte Verhältnis:
-
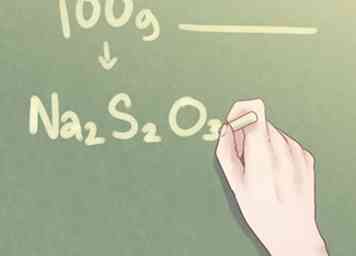 7 Schreibe deine endgültige Antwort. Übersetzen Sie das Verhältnis der Elemente in das für die empirische Formel verwendete Standardformat. Die molekulare Menge jedes Elements sollte neben dem jeweiligen Symbol des Elements für alle Mengen, die größer als eins sind, mit einem Index versehen sein.
7 Schreibe deine endgültige Antwort. Übersetzen Sie das Verhältnis der Elemente in das für die empirische Formel verwendete Standardformat. Die molekulare Menge jedes Elements sollte neben dem jeweiligen Symbol des Elements für alle Mengen, die größer als eins sind, mit einem Index versehen sein. - Beispiel: Für eine Verbindung, die 2 Teile Na, 2 Teile S und 3 Teile O ist, sollte die empirische Formel geschrieben werden als: Na2S2O3
Methode zwei von drei:
Methode 2: Verwenden von Gewicht in Gramm
-
 1 Berücksichtigen Sie die Anzahl der Gramm. Wenn Sie die elementare Zusammensetzung einer unbekannten Substanz in Gramm erhalten, müssen Sie gemäß den folgenden Anweisungen vorgehen.
1 Berücksichtigen Sie die Anzahl der Gramm. Wenn Sie die elementare Zusammensetzung einer unbekannten Substanz in Gramm erhalten, müssen Sie gemäß den folgenden Anweisungen vorgehen. - Wenn Sie jedoch die Zusammensetzung in Prozent anstelle von Gramm erhalten, lesen Sie die Anweisungen unter "Verwenden von Gewichtsprozenten".
- Beispiel: Bestimmen Sie die empirische Formel einer unbekannten Substanz aus 8,5 g Fe (Eisen) und 3,8 g O (Sauerstoff).
-
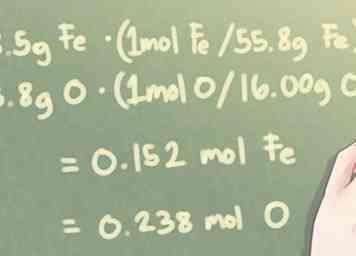 2 Konvertiere die Masse jedes Elements in Mol. Um das molekulare Verhältnis der Elemente in der Verbindung zu bestimmen, müssen Sie die Menge jedes Elements von Gramm in Mol umrechnen. Tun Sie dies, indem Sie die Masse in Gramm für jedes Element durch die jeweiligen Atomgewichte der Elemente dividieren.
2 Konvertiere die Masse jedes Elements in Mol. Um das molekulare Verhältnis der Elemente in der Verbindung zu bestimmen, müssen Sie die Menge jedes Elements von Gramm in Mol umrechnen. Tun Sie dies, indem Sie die Masse in Gramm für jedes Element durch die jeweiligen Atomgewichte der Elemente dividieren. - Aus einer eher technischen Perspektive multipliziert man tatsächlich die Masse in Gramm mit dem Molverhältnis pro Atomgewicht.
- Beachten Sie, dass das Atomgewicht auf vier signifikante Stellen gerundet werden sollte, um eine gewisse Genauigkeit in Ihren Berechnungen zu erhalten.
- Beispiel: Wenn es 8,5 g Fe und 3,8 g O:
- 8,5 g Fe * (1 mol Fe / 55,85 g Fe) = 0,152 mol Fe
- 3,8 g O * (1 mol O / 16,00 g O) = 0,238 mol O
-
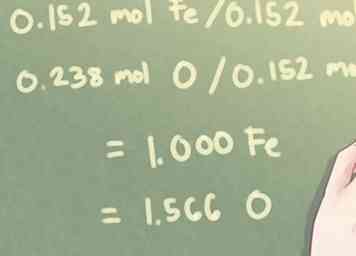 3 Teilen Sie jeden Molwert mit der kleinsten berechneten Zahl. Bestimmen Sie, wie viel von jedem Element im Vergleich zu den anderen Elementen in der Verbindung vorhanden ist.Um dies zu berechnen, müssen Sie die kleinste Anzahl von vorhandenen Molen identifizieren und jede Molzahl durch diese Zahl dividieren.
3 Teilen Sie jeden Molwert mit der kleinsten berechneten Zahl. Bestimmen Sie, wie viel von jedem Element im Vergleich zu den anderen Elementen in der Verbindung vorhanden ist.Um dies zu berechnen, müssen Sie die kleinste Anzahl von vorhandenen Molen identifizieren und jede Molzahl durch diese Zahl dividieren. - Beispiel: Für dieses Problem ist die kleinste Menge an vorhandenen Molen 0,152 Mol (die Menge an Fe, Eisen, vorhanden).
- 0,152 mol Fe / 0,152 mol = 1.000 Fe
- 0,238 mol O / 0,152 mol = 1,566 O
- Beispiel: Für dieses Problem ist die kleinste Menge an vorhandenen Molen 0,152 Mol (die Menge an Fe, Eisen, vorhanden).
-
 4 Multiplizieren Sie die Verhältniswerte, um fast ganze Zahlen zu finden. Oftmals sind die für jede Substanz vorhandenen Mole nicht gleich einer ganzen Zahl. Wenn der Überschuss innerhalb von einem Zehntel liegt, können Sie ihn einfach abrunden. Für darüber hinausgehende Überschreitungen müssen Sie jedoch jeden Wert mit einer Zahl multiplizieren, die den Verhältniswert näher an eine ganze Zahl bringen kann.
4 Multiplizieren Sie die Verhältniswerte, um fast ganze Zahlen zu finden. Oftmals sind die für jede Substanz vorhandenen Mole nicht gleich einer ganzen Zahl. Wenn der Überschuss innerhalb von einem Zehntel liegt, können Sie ihn einfach abrunden. Für darüber hinausgehende Überschreitungen müssen Sie jedoch jeden Wert mit einer Zahl multiplizieren, die den Verhältniswert näher an eine ganze Zahl bringen kann. - Wenn beispielsweise ein Element einen Überschuss nahe 0,25 aufweist, multiplizieren Sie jede Elementmenge mit 4. Wenn ein Element einen Überschuss nahe 0,5 aufweist, multiplizieren Sie jede Elementmenge mit 2.
- Beispiel: Da die Verhältnismenge von Sauerstoff gleich 1,566 ist, müssen Sie beide Verhältnismengen mit 2 multiplizieren.
- 1.000 Fe * 2 = 2.000 Fe
- 1,566 O * 2 = 3,132 O
-
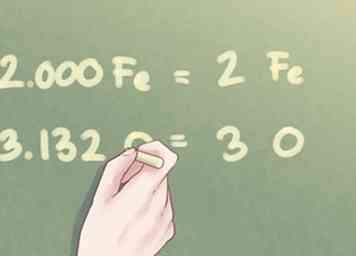 5 Runden Sie Ihre Antwort auf die nächste ganze Zahl ab. Sobald die Verhältniswerte aller Elemente in der Verbindung ungefähr innerhalb eines Zehntel einer ganzen Zahl liegen, können Sie jede Differenz auf die nächste ganze Zahl abrunden.
5 Runden Sie Ihre Antwort auf die nächste ganze Zahl ab. Sobald die Verhältniswerte aller Elemente in der Verbindung ungefähr innerhalb eines Zehntel einer ganzen Zahl liegen, können Sie jede Differenz auf die nächste ganze Zahl abrunden. - Beispiel: Die Menge an Fe kann als 2 geschrieben werden. Die Menge an O kann auf 3 abgerundet werden.
-
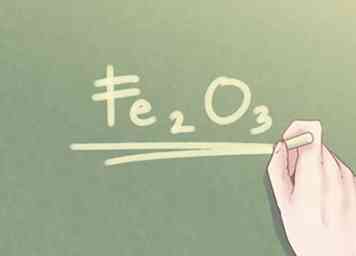 6 Schreibe die endgültige Antwort. Das Verhältnis der Elemente sollte in empirischer Formelform umgeschrieben werden. Jeder Verhältniswert sollte neben dem jeweiligen Symbol des Elements als Index angegeben werden, es sei denn, der Verhältniswert ist gleich Eins.
6 Schreibe die endgültige Antwort. Das Verhältnis der Elemente sollte in empirischer Formelform umgeschrieben werden. Jeder Verhältniswert sollte neben dem jeweiligen Symbol des Elements als Index angegeben werden, es sei denn, der Verhältniswert ist gleich Eins. - Beispiel: Für eine Verbindung, die 2 Teile Fe und 3 Teile O ist, lautet die empirische Formel: Fe2O3
Methode drei von drei:
Methode 3: Verwendung der Molekülformel [2]
-
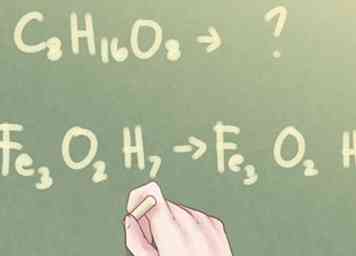 1 Bestimmen Sie, ob die Indizes reduziert werden können. Wenn Sie die Molekülformel einer unbekannten Verbindung haben, aber die Verbindung nach ihrer empirischen Formel identifizieren sollen, müssen Sie bestimmen, ob die Formel reduziert werden kann. Sehen Sie sich die Indizes für jedes vorhandene Element an. Wenn alle drei Indizes mindestens einen gemeinsamen Faktor (außer der Zahl 1) haben, müssen Sie einige weitere Schritte durchführen, um die empirische Formel der Verbindung zu bestimmen.
1 Bestimmen Sie, ob die Indizes reduziert werden können. Wenn Sie die Molekülformel einer unbekannten Verbindung haben, aber die Verbindung nach ihrer empirischen Formel identifizieren sollen, müssen Sie bestimmen, ob die Formel reduziert werden kann. Sehen Sie sich die Indizes für jedes vorhandene Element an. Wenn alle drei Indizes mindestens einen gemeinsamen Faktor (außer der Zahl 1) haben, müssen Sie einige weitere Schritte durchführen, um die empirische Formel der Verbindung zu bestimmen. - Beispiel: C8H16O8
- Auf der anderen Seite, wenn die Indizes nicht alle einen gemeinsamen Faktor haben, ist die molekulare Formel auch die empirische Formel.
- Beispiel: Fe3O2H7
-
 2 Finde den größten gemeinsamen Faktor zwischen den Indizes. Schreibe die Faktoren jedes Indexes in deine Formel. Identifizieren Sie, welcher Faktor den größten Wert hat.
2 Finde den größten gemeinsamen Faktor zwischen den Indizes. Schreibe die Faktoren jedes Indexes in deine Formel. Identifizieren Sie, welcher Faktor den größten Wert hat. - Beispiel: Für C8H16O8Die Indizes sind "16" und "8".
- Die Faktoren von 8 sind: 1, 2, 4, 8
- Die Faktoren von 16 sind: 1, 2, 4, 8, 16
- Der größte gemeinsame Faktor (GCF) zwischen den beiden Zahlen ist 8.
- Beispiel: Für C8H16O8Die Indizes sind "16" und "8".
-
 3 Teilen Sie jeden Index durch den größten gemeinsamen Faktor. Um jeden Index in seiner einfachsten Form zu erhalten, müssen Sie alle in der Formel vorhandenen Indizes durch den GCF, den Sie gerade gefunden haben, teilen.
3 Teilen Sie jeden Index durch den größten gemeinsamen Faktor. Um jeden Index in seiner einfachsten Form zu erhalten, müssen Sie alle in der Formel vorhandenen Indizes durch den GCF, den Sie gerade gefunden haben, teilen. - Beispiel: Für C8H16O8:
- Teilen Sie den Index von 8 durch den GCF von 8: 8/8 = 1
- Teilen Sie den Index von 16 durch den GCF von 8: 16/8 = 2
- Beispiel: Für C8H16O8:
-
 4 Schreibe die endgültige Antwort. Ersetzen Sie Ihre ursprünglichen Indizes durch ihre vereinfachten Werte. Sie haben dabei die Summenformel der Verbindung aus ihrer Molekülformel bestimmt.
4 Schreibe die endgültige Antwort. Ersetzen Sie Ihre ursprünglichen Indizes durch ihre vereinfachten Werte. Sie haben dabei die Summenformel der Verbindung aus ihrer Molekülformel bestimmt. - Beachten Sie, dass Werte von 1 normalerweise nicht mit Indizes angezeigt werden.
- Beispiel: C8H16O8 = CH2O
Facebook
Twitter
Google+
 Minotauromaquia
Minotauromaquia
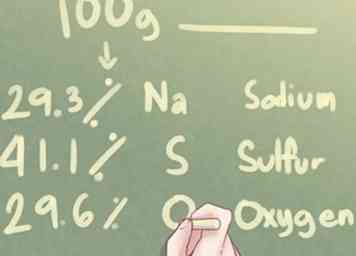 1 Schau dir die Daten an. Wenn Sie die Elementzusammensetzung einer unbekannten Verbindung in Prozent und nicht in Gramm angeben, sollten Sie davon ausgehen, dass genau 100,0 Gramm der Substanz beteiligt sind.
1 Schau dir die Daten an. Wenn Sie die Elementzusammensetzung einer unbekannten Verbindung in Prozent und nicht in Gramm angeben, sollten Sie davon ausgehen, dass genau 100,0 Gramm der Substanz beteiligt sind.  2 Bestimmen Sie die Anzahl der Gramm für jedes Element. Basierend auf der Annahme, dass 100 Gramm der unbekannten Substanz vorhanden sind, können Sie feststellen, dass die Anzahl der vorhandenen Gramm für jedes Element dem prozentualen Wert jedes Elements entspricht, das in dem Problem erwähnt wird.
2 Bestimmen Sie die Anzahl der Gramm für jedes Element. Basierend auf der Annahme, dass 100 Gramm der unbekannten Substanz vorhanden sind, können Sie feststellen, dass die Anzahl der vorhandenen Gramm für jedes Element dem prozentualen Wert jedes Elements entspricht, das in dem Problem erwähnt wird. 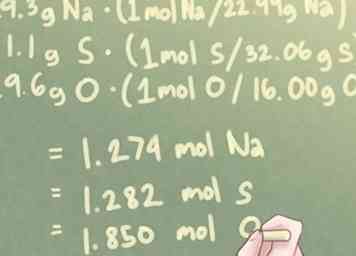 3 Wandle die Masse jedes Elements in Mol um. Die Masse jedes Elements in Ihrer Zusammensetzung, die gegenwärtig in Gramm ausgedrückt wird, muss in Mole umgewandelt werden. Dazu muss jede Masse mit dem Molverhältnis ihrer jeweiligen Atomgewichte multipliziert werden.
3 Wandle die Masse jedes Elements in Mol um. Die Masse jedes Elements in Ihrer Zusammensetzung, die gegenwärtig in Gramm ausgedrückt wird, muss in Mole umgewandelt werden. Dazu muss jede Masse mit dem Molverhältnis ihrer jeweiligen Atomgewichte multipliziert werden.  4 Teilen Sie jeden Molwert durch die kleinste Anzahl vorhandener Mole. Du wirst ein brauchen stöchiometrisch Vergleich zwischen den Elementen in Ihrer Verbindung, was im Wesentlichen bedeutet, dass Sie berechnen müssen, wie viel eines Elements Sie in Bezug auf die anderen Elemente in Ihrer Verbindung haben. Um dies zu tun, dividiere jede Anzahl von Molen durch die kleinste Anzahl von vorhandenen Molen.
4 Teilen Sie jeden Molwert durch die kleinste Anzahl vorhandener Mole. Du wirst ein brauchen stöchiometrisch Vergleich zwischen den Elementen in Ihrer Verbindung, was im Wesentlichen bedeutet, dass Sie berechnen müssen, wie viel eines Elements Sie in Bezug auf die anderen Elemente in Ihrer Verbindung haben. Um dies zu tun, dividiere jede Anzahl von Molen durch die kleinste Anzahl von vorhandenen Molen. 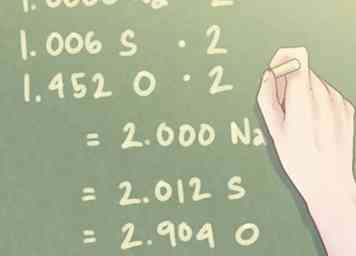 5 Multiplizieren Sie die Verhältniswerte, um fast ganze Zahlen zu finden. Die Menge an Molen, die für jedes Element vorhanden ist, kann nicht ganzzahlig sein. Für kleine Werte, die innerhalb eines zehnten Werts von einer ganzen Zahl entfernt sind, ist dies kein Problem. Wenn Sie jedoch einen Überschuß haben, der diesen Betrag übersteigt, sollten Sie die Verhältniswerte nach Bedarf multiplizieren, um diesen Wert auf eine ganze Zahl zu erhöhen.
5 Multiplizieren Sie die Verhältniswerte, um fast ganze Zahlen zu finden. Die Menge an Molen, die für jedes Element vorhanden ist, kann nicht ganzzahlig sein. Für kleine Werte, die innerhalb eines zehnten Werts von einer ganzen Zahl entfernt sind, ist dies kein Problem. Wenn Sie jedoch einen Überschuß haben, der diesen Betrag übersteigt, sollten Sie die Verhältniswerte nach Bedarf multiplizieren, um diesen Wert auf eine ganze Zahl zu erhöhen. 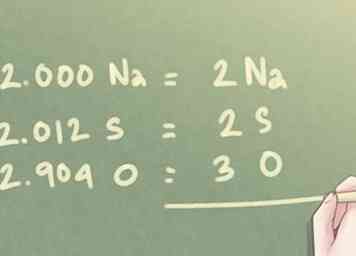 6 Runden Sie die Werte auf die nächsten ganzen Zahlen ab. Selbst nach dem letzten Schritt kann die Menge an Molen, die für jedes Element vorhanden sind, nicht in genauen ganzen Zahlen sein. Da in empirischen Formeln keine Dezimalstellen verwendet werden, müssen Sie jeden Wert auf die nächste ganze Zahl runden.
6 Runden Sie die Werte auf die nächsten ganzen Zahlen ab. Selbst nach dem letzten Schritt kann die Menge an Molen, die für jedes Element vorhanden sind, nicht in genauen ganzen Zahlen sein. Da in empirischen Formeln keine Dezimalstellen verwendet werden, müssen Sie jeden Wert auf die nächste ganze Zahl runden. 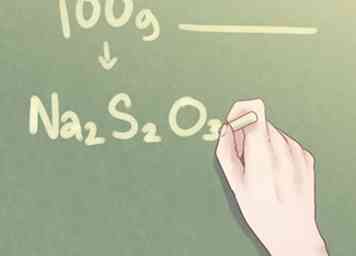 7 Schreibe deine endgültige Antwort. Übersetzen Sie das Verhältnis der Elemente in das für die empirische Formel verwendete Standardformat. Die molekulare Menge jedes Elements sollte neben dem jeweiligen Symbol des Elements für alle Mengen, die größer als eins sind, mit einem Index versehen sein.
7 Schreibe deine endgültige Antwort. Übersetzen Sie das Verhältnis der Elemente in das für die empirische Formel verwendete Standardformat. Die molekulare Menge jedes Elements sollte neben dem jeweiligen Symbol des Elements für alle Mengen, die größer als eins sind, mit einem Index versehen sein.  1 Berücksichtigen Sie die Anzahl der Gramm. Wenn Sie die elementare Zusammensetzung einer unbekannten Substanz in Gramm erhalten, müssen Sie gemäß den folgenden Anweisungen vorgehen.
1 Berücksichtigen Sie die Anzahl der Gramm. Wenn Sie die elementare Zusammensetzung einer unbekannten Substanz in Gramm erhalten, müssen Sie gemäß den folgenden Anweisungen vorgehen. 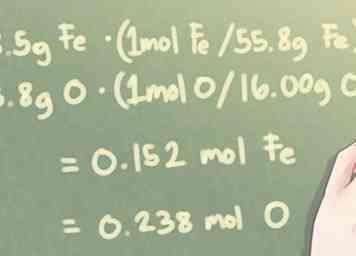 2 Konvertiere die Masse jedes Elements in Mol. Um das molekulare Verhältnis der Elemente in der Verbindung zu bestimmen, müssen Sie die Menge jedes Elements von Gramm in Mol umrechnen. Tun Sie dies, indem Sie die Masse in Gramm für jedes Element durch die jeweiligen Atomgewichte der Elemente dividieren.
2 Konvertiere die Masse jedes Elements in Mol. Um das molekulare Verhältnis der Elemente in der Verbindung zu bestimmen, müssen Sie die Menge jedes Elements von Gramm in Mol umrechnen. Tun Sie dies, indem Sie die Masse in Gramm für jedes Element durch die jeweiligen Atomgewichte der Elemente dividieren. 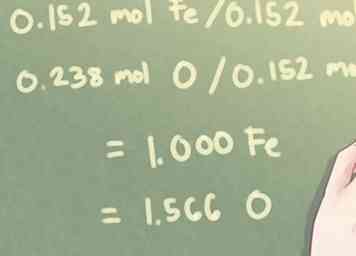 3 Teilen Sie jeden Molwert mit der kleinsten berechneten Zahl. Bestimmen Sie, wie viel von jedem Element im Vergleich zu den anderen Elementen in der Verbindung vorhanden ist.Um dies zu berechnen, müssen Sie die kleinste Anzahl von vorhandenen Molen identifizieren und jede Molzahl durch diese Zahl dividieren.
3 Teilen Sie jeden Molwert mit der kleinsten berechneten Zahl. Bestimmen Sie, wie viel von jedem Element im Vergleich zu den anderen Elementen in der Verbindung vorhanden ist.Um dies zu berechnen, müssen Sie die kleinste Anzahl von vorhandenen Molen identifizieren und jede Molzahl durch diese Zahl dividieren.  4 Multiplizieren Sie die Verhältniswerte, um fast ganze Zahlen zu finden. Oftmals sind die für jede Substanz vorhandenen Mole nicht gleich einer ganzen Zahl. Wenn der Überschuss innerhalb von einem Zehntel liegt, können Sie ihn einfach abrunden. Für darüber hinausgehende Überschreitungen müssen Sie jedoch jeden Wert mit einer Zahl multiplizieren, die den Verhältniswert näher an eine ganze Zahl bringen kann.
4 Multiplizieren Sie die Verhältniswerte, um fast ganze Zahlen zu finden. Oftmals sind die für jede Substanz vorhandenen Mole nicht gleich einer ganzen Zahl. Wenn der Überschuss innerhalb von einem Zehntel liegt, können Sie ihn einfach abrunden. Für darüber hinausgehende Überschreitungen müssen Sie jedoch jeden Wert mit einer Zahl multiplizieren, die den Verhältniswert näher an eine ganze Zahl bringen kann. 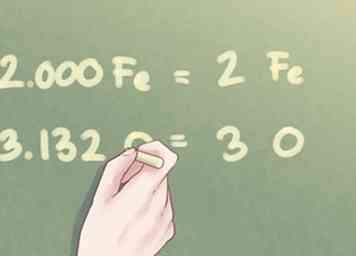 5 Runden Sie Ihre Antwort auf die nächste ganze Zahl ab. Sobald die Verhältniswerte aller Elemente in der Verbindung ungefähr innerhalb eines Zehntel einer ganzen Zahl liegen, können Sie jede Differenz auf die nächste ganze Zahl abrunden.
5 Runden Sie Ihre Antwort auf die nächste ganze Zahl ab. Sobald die Verhältniswerte aller Elemente in der Verbindung ungefähr innerhalb eines Zehntel einer ganzen Zahl liegen, können Sie jede Differenz auf die nächste ganze Zahl abrunden. 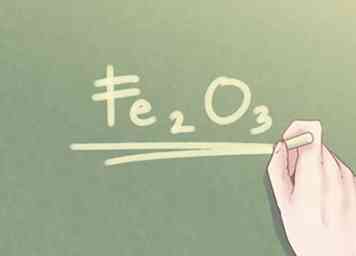 6 Schreibe die endgültige Antwort. Das Verhältnis der Elemente sollte in empirischer Formelform umgeschrieben werden. Jeder Verhältniswert sollte neben dem jeweiligen Symbol des Elements als Index angegeben werden, es sei denn, der Verhältniswert ist gleich Eins.
6 Schreibe die endgültige Antwort. Das Verhältnis der Elemente sollte in empirischer Formelform umgeschrieben werden. Jeder Verhältniswert sollte neben dem jeweiligen Symbol des Elements als Index angegeben werden, es sei denn, der Verhältniswert ist gleich Eins. 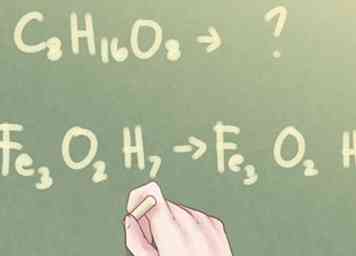 1 Bestimmen Sie, ob die Indizes reduziert werden können. Wenn Sie die Molekülformel einer unbekannten Verbindung haben, aber die Verbindung nach ihrer empirischen Formel identifizieren sollen, müssen Sie bestimmen, ob die Formel reduziert werden kann. Sehen Sie sich die Indizes für jedes vorhandene Element an. Wenn alle drei Indizes mindestens einen gemeinsamen Faktor (außer der Zahl 1) haben, müssen Sie einige weitere Schritte durchführen, um die empirische Formel der Verbindung zu bestimmen.
1 Bestimmen Sie, ob die Indizes reduziert werden können. Wenn Sie die Molekülformel einer unbekannten Verbindung haben, aber die Verbindung nach ihrer empirischen Formel identifizieren sollen, müssen Sie bestimmen, ob die Formel reduziert werden kann. Sehen Sie sich die Indizes für jedes vorhandene Element an. Wenn alle drei Indizes mindestens einen gemeinsamen Faktor (außer der Zahl 1) haben, müssen Sie einige weitere Schritte durchführen, um die empirische Formel der Verbindung zu bestimmen.  2 Finde den größten gemeinsamen Faktor zwischen den Indizes. Schreibe die Faktoren jedes Indexes in deine Formel. Identifizieren Sie, welcher Faktor den größten Wert hat.
2 Finde den größten gemeinsamen Faktor zwischen den Indizes. Schreibe die Faktoren jedes Indexes in deine Formel. Identifizieren Sie, welcher Faktor den größten Wert hat.  3 Teilen Sie jeden Index durch den größten gemeinsamen Faktor. Um jeden Index in seiner einfachsten Form zu erhalten, müssen Sie alle in der Formel vorhandenen Indizes durch den GCF, den Sie gerade gefunden haben, teilen.
3 Teilen Sie jeden Index durch den größten gemeinsamen Faktor. Um jeden Index in seiner einfachsten Form zu erhalten, müssen Sie alle in der Formel vorhandenen Indizes durch den GCF, den Sie gerade gefunden haben, teilen.  4 Schreibe die endgültige Antwort. Ersetzen Sie Ihre ursprünglichen Indizes durch ihre vereinfachten Werte. Sie haben dabei die Summenformel der Verbindung aus ihrer Molekülformel bestimmt.
4 Schreibe die endgültige Antwort. Ersetzen Sie Ihre ursprünglichen Indizes durch ihre vereinfachten Werte. Sie haben dabei die Summenformel der Verbindung aus ihrer Molekülformel bestimmt.