Die Dichte ist definiert als die Menge an Masse, die in einem gegebenen Volumen vorhanden ist. Für Feststoffe und Flüssigkeiten ist dies eine ziemlich einfache Messung. Gase reagieren jedoch extrem empfindlich auf Temperatur und Druck (mehr als Feststoffe oder Flüssigkeiten), was dazu führen kann, dass sich ihre Dichten ziemlich schnell ändern. Wenn Sie die Dichte experimentell bestimmen, müssen Sie diese Temperatur- und Druckempfindlichkeit berücksichtigen. Wenn Sie beabsichtigen, die theoretische Dichte eines Gases zu finden, müssen Sie das Idealgasgesetz verwenden, um alle Variablen zu berücksichtigen.
Methode eins von dreien:
Bestimmung der Dichte von Gas experimentell
-
 1 Fülle einen Ballon. Ein Ballon ist so konstruiert, dass er durch Gas aufgeblasen wird, was ihn zum perfekten Gefäß für die Speicherung einer bestimmten Menge an Gas macht. Sie können den Ballon mit Luft mit einer Pumpe füllen, oder Sie können eine andere Art von Gas wie Helium oder Stickstoff wählen. Sobald der Ballon gefüllt ist, binden Sie das Ende ab, so dass kein Gas entweicht.[1]
1 Fülle einen Ballon. Ein Ballon ist so konstruiert, dass er durch Gas aufgeblasen wird, was ihn zum perfekten Gefäß für die Speicherung einer bestimmten Menge an Gas macht. Sie können den Ballon mit Luft mit einer Pumpe füllen, oder Sie können eine andere Art von Gas wie Helium oder Stickstoff wählen. Sobald der Ballon gefüllt ist, binden Sie das Ende ab, so dass kein Gas entweicht.[1] -
 2 Tauchen Sie den Ballon vollständig in einen durchsichtigen Behälter. Als nächstes tauchen Sie den Ballon in einen Behälter mit Wasser. Der Ballon wird den Wasserstand ansteigen lassen. Markieren Sie die neue Höhe des Wassers und entfernen Sie den Ballon.[2]
2 Tauchen Sie den Ballon vollständig in einen durchsichtigen Behälter. Als nächstes tauchen Sie den Ballon in einen Behälter mit Wasser. Der Ballon wird den Wasserstand ansteigen lassen. Markieren Sie die neue Höhe des Wassers und entfernen Sie den Ballon.[2] -
 3 Messen Sie die Menge des verdrängten Wassers. Verwenden Sie ein Messgerät (z. B. eine Tasse oder einen Becher), um die Wassermenge zu messen, die benötigt wird, um den Behälter bis zur Markierung zu füllen (ohne den Ballon im Wasser). Gieße langsam. Wenn Sie zu viel gießen, müssen Sie von vorne beginnen. Das Volumen des Ballons entspricht dem Volumen des Wassers, das Sie hinzufügen. Notieren Sie diesen Wert für die spätere Verwendung als V.[3]
3 Messen Sie die Menge des verdrängten Wassers. Verwenden Sie ein Messgerät (z. B. eine Tasse oder einen Becher), um die Wassermenge zu messen, die benötigt wird, um den Behälter bis zur Markierung zu füllen (ohne den Ballon im Wasser). Gieße langsam. Wenn Sie zu viel gießen, müssen Sie von vorne beginnen. Das Volumen des Ballons entspricht dem Volumen des Wassers, das Sie hinzufügen. Notieren Sie diesen Wert für die spätere Verwendung als V.[3] - Sie können Zeit sparen, indem Sie den Ballon in einen großen Becher oder einen anderen vordosierten Behälter tauchen. Dann können Sie das Hinzufügen von Wasser überspringen und einfach das Volumen des Wassers vom Volumen des Wassers und des Ballons subtrahieren.
-
 4 Wiege den mit Gas gefüllten Ballon ab. Sie können den Ballon mit einer empfindlichen Waage wiegen. Elektrische Waagen sind normalerweise die besten für diese Anwendung. Notieren Sie das Gewicht des gasgefüllten Ballons für die spätere Verwendung als mGB.[4]
4 Wiege den mit Gas gefüllten Ballon ab. Sie können den Ballon mit einer empfindlichen Waage wiegen. Elektrische Waagen sind normalerweise die besten für diese Anwendung. Notieren Sie das Gewicht des gasgefüllten Ballons für die spätere Verwendung als mGB.[4] - Wenn Sie den Ballon mit einem Gas füllen, das leichter als Luft ist, müssen Sie die Aufnahme vor und nach dem Füllen des Ballons abwägen, um die Menge des verwendeten Gases zu bestimmen.
-
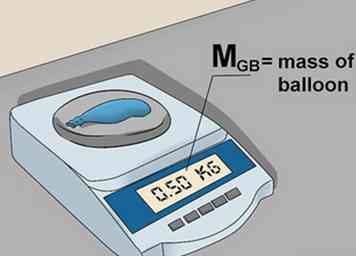 5 Finde die Masse des leeren Ballons. Stechen Sie ein Loch in den Ballon. Dadurch kann das Gas entweichen. Wiegen Sie den Ballon erneut und notieren Sie das Gewicht des leeren Ballons als mB.[5]
5 Finde die Masse des leeren Ballons. Stechen Sie ein Loch in den Ballon. Dadurch kann das Gas entweichen. Wiegen Sie den Ballon erneut und notieren Sie das Gewicht des leeren Ballons als mB.[5] -
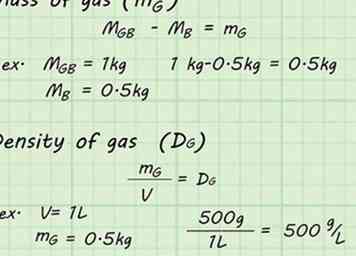 6 Mach die Berechnungen. Jetzt, da Sie genügend Daten haben, können Sie die Dichte des Gases im Ballon berechnen. Subtrahiere das Gewicht des leeren Ballons, mB, vom Gewicht des vollen Ballons, mGB. Dies gibt Ihnen die Masse des Gases allein, mG. Teilen Sie die Masse des Gases, mGdurch das Volumen V des Gases, um die Dichte des Gases zu finden, DG.[6]
6 Mach die Berechnungen. Jetzt, da Sie genügend Daten haben, können Sie die Dichte des Gases im Ballon berechnen. Subtrahiere das Gewicht des leeren Ballons, mB, vom Gewicht des vollen Ballons, mGB. Dies gibt Ihnen die Masse des Gases allein, mG. Teilen Sie die Masse des Gases, mGdurch das Volumen V des Gases, um die Dichte des Gases zu finden, DG.[6] - mGB - mB = mG
- Wenn zum Beispiel der volle Ballon eine Masse von 1 kg hätte und der leere Ballon eine Masse von 0,5 kg hätte, würde die Masse des Gases (mG) würde gefunden werden durch: 1 kg - 0,5 kg = 0,5 kg.
- mG / V = DG
- Zum Beispiel, wenn der Ballon 1 l Wasser verdrängt, könnte die Dichte durch Teilen der Masse durch dieses Volumen gefunden werden: 500 g / 1 L = 500 g / l
- mGB - mB = mG
Methode zwei von drei:
Die theoretische Dichte eines Gases finden
-
 1 Verstehen Sie das ideale Gasgesetz. Sie sollten wissen, dass das Idealgasgesetz ein theoretisches Werkzeug ist, das das Verhalten von Gasen unter bestimmten Bedingungen bestimmt. Sie können es in der Gleichung PV = nRT zusammenfassen. Das bedeutet einfach, dass der Druck (P) multipliziert mit dem Volumen (V) gleich der Anzahl der Mole (n) mal der idealen Gaskonstante (R) multipliziert mit der absoluten Temperatur (T) für ein ideales Gas ist. [7]
1 Verstehen Sie das ideale Gasgesetz. Sie sollten wissen, dass das Idealgasgesetz ein theoretisches Werkzeug ist, das das Verhalten von Gasen unter bestimmten Bedingungen bestimmt. Sie können es in der Gleichung PV = nRT zusammenfassen. Das bedeutet einfach, dass der Druck (P) multipliziert mit dem Volumen (V) gleich der Anzahl der Mole (n) mal der idealen Gaskonstante (R) multipliziert mit der absoluten Temperatur (T) für ein ideales Gas ist. [7] - Ein Mol (n) ist gleich 6,022 * 10 ^ 23 Gasmolekülen.
- Die ideale Gaskonstante (R) beträgt 0,0821 L · atm / mol · K.
- Die absolute Temperatur wird in Kelvin (K) gemessen.
-
 2 Angenommen, Standardtemperatur und -druck. Standardtemperatur und -druck oder STP sind als 273 K (32 ° F) (0 ° C) und 1 Standardatmosphäre (1,0 bar) definiert. Angenommen, STP ermöglicht es Ihnen, das Volumen von 1 Mol eines beliebigen Gases auf 22,414 Liter zu berechnen. Die Kenntnis dieses Volumens ist unerlässlich, um die Dichte Ihres Gases zu finden.[8]
2 Angenommen, Standardtemperatur und -druck. Standardtemperatur und -druck oder STP sind als 273 K (32 ° F) (0 ° C) und 1 Standardatmosphäre (1,0 bar) definiert. Angenommen, STP ermöglicht es Ihnen, das Volumen von 1 Mol eines beliebigen Gases auf 22,414 Liter zu berechnen. Die Kenntnis dieses Volumens ist unerlässlich, um die Dichte Ihres Gases zu finden.[8] -
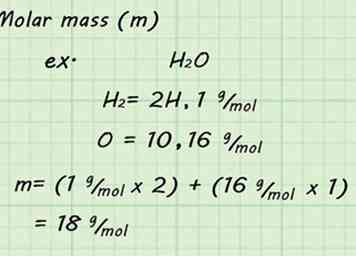 3 Finde die molare Masse des Gases. Da Sie STP verwenden und ein Mol Gas annehmen, ist das Auffinden der Molmasse einfach. Addiere die Molmasse aller einzelnen Atome, aus denen du Gas hast, um die Molmasse des Gases zu finden. Die atomaren Massen können im Periodensystem gefunden werden.[9]
3 Finde die molare Masse des Gases. Da Sie STP verwenden und ein Mol Gas annehmen, ist das Auffinden der Molmasse einfach. Addiere die Molmasse aller einzelnen Atome, aus denen du Gas hast, um die Molmasse des Gases zu finden. Die atomaren Massen können im Periodensystem gefunden werden.[9] - Zum Beispiel, die Molmasse von H zu finden2O-Gas würde bedeuten, die Massen von 2 Wasserstoffen und 1 Sauerstoff hinzuzufügen. Die resultierende Molmasse wäre 18 g / mol (1 g / mol + 1 g / mol + 16 g / mol).
-
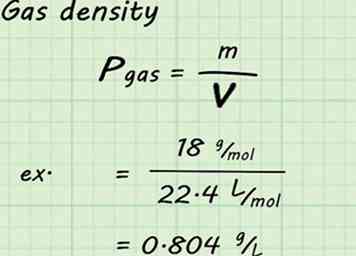 4 Berechnen Sie die Dichte des Gases. Obwohl das Volumen und die Mole von Gas in diesen Berechnungen fixiert sind, ist die Molmasse für jedes Gas unterschiedlich. Das bedeutet, dass die Dichte für jedes Gas unterschiedlich ist. Um eine gegebene Gasdichte zu finden, teilen Sie die Molmasse des Gases durch das Molvolumen (in diesem Fall 22,4 L / mol).[10]
4 Berechnen Sie die Dichte des Gases. Obwohl das Volumen und die Mole von Gas in diesen Berechnungen fixiert sind, ist die Molmasse für jedes Gas unterschiedlich. Das bedeutet, dass die Dichte für jedes Gas unterschiedlich ist. Um eine gegebene Gasdichte zu finden, teilen Sie die Molmasse des Gases durch das Molvolumen (in diesem Fall 22,4 L / mol).[10] - Wenn Sie beispielsweise nach der Dichte von Wasserdampf suchen, würden Sie 18 g / mol durch 22,4 l / mol teilen, um 0,804 g / l zu erhalten. Das heißt: 18 g / mol / 22,4 l / mol = 0,804 g / l.
Methode drei von drei:
Die theoretische Dichte einer Gasmischung finden
-
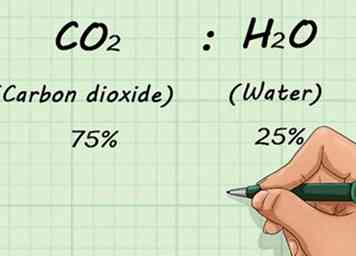 1 Kenne den fraktionellen Abbau des Gasgemisches. Wenn Sie zwei oder mehr Gase gemischt haben, müssen Sie wissen, wie viel von jedem Gas vorhanden ist. Dies geschieht prozentual. Dadurch können Sie die Verhältnisse der Mischung unabhängig davon, wie viel Gas insgesamt vorhanden ist, kennen.[11]
1 Kenne den fraktionellen Abbau des Gasgemisches. Wenn Sie zwei oder mehr Gase gemischt haben, müssen Sie wissen, wie viel von jedem Gas vorhanden ist. Dies geschieht prozentual. Dadurch können Sie die Verhältnisse der Mischung unabhängig davon, wie viel Gas insgesamt vorhanden ist, kennen.[11] - Zum Beispiel, wenn Sie eine Mischung von 75% CO hatten2 (Kohlendioxid) und 25% H2O (Wasser), diese Verhältnisse würden sich nicht ändern, ob Sie 1 L oder 1000 L Gas haben.
-
 2 Finde die Masse von einem Maulwurf. Wenn Sie das Verhältnis Ihrer Gase kennen, können Sie die Molmasse Ihrer Mischung finden. Sie müssen die Molmasse jedes Gases finden und es mit seiner prozentualen Zusammensetzung in der Mischung multiplizieren. Dann füge alle Produkte zusammen, um die Molmasse des Gasgemisches zu finden.[12]
2 Finde die Masse von einem Maulwurf. Wenn Sie das Verhältnis Ihrer Gase kennen, können Sie die Molmasse Ihrer Mischung finden. Sie müssen die Molmasse jedes Gases finden und es mit seiner prozentualen Zusammensetzung in der Mischung multiplizieren. Dann füge alle Produkte zusammen, um die Molmasse des Gasgemisches zu finden.[12] - Zum Beispiel würden Sie die Molmasse von CO finden2 (44 g / mol) und multipliziere es mit 0,75. Als nächstes würden Sie die Molmasse von H finden2O (18 g / mol) und multipliziere es mit 0,25. Wenn Sie diese Produkte zusammengeben, 33 g / mol + 4,5 g / mol, ergeben Sie die Molmasse Ihrer Mischung. In diesem Fall beträgt die Molmasse 37,5 g / mol.
-
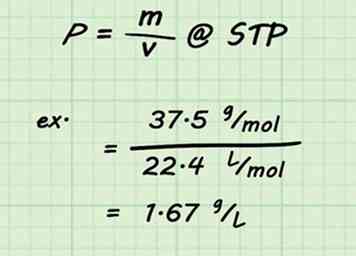 3 Teile durch das Volumen. Sobald die Molmasse für Ihre Mischung festgelegt wurde, ist die Ermittlung der Dichte des Gases eine einfache Berechnung. Teilen Sie die Molmasse durch das Standardvolumen (22,4 L / mol). Denken Sie daran, dass Sie STP und 1 Mol Gas annehmen.[13]
3 Teile durch das Volumen. Sobald die Molmasse für Ihre Mischung festgelegt wurde, ist die Ermittlung der Dichte des Gases eine einfache Berechnung. Teilen Sie die Molmasse durch das Standardvolumen (22,4 L / mol). Denken Sie daran, dass Sie STP und 1 Mol Gas annehmen.[13] - Zum Beispiel wäre die Dichte einer Mischung aus 75% Kohlendioxid und 25% Wasser .
- Sie müssen die Formel für das ideale Gasgesetz für Ihre Berechnungen anwenden, wenn das Gas nicht auf STP ist (PV = nRT).
 Minotauromaquia
Minotauromaquia
 1 Fülle einen Ballon. Ein Ballon ist so konstruiert, dass er durch Gas aufgeblasen wird, was ihn zum perfekten Gefäß für die Speicherung einer bestimmten Menge an Gas macht. Sie können den Ballon mit Luft mit einer Pumpe füllen, oder Sie können eine andere Art von Gas wie Helium oder Stickstoff wählen. Sobald der Ballon gefüllt ist, binden Sie das Ende ab, so dass kein Gas entweicht.[1]
1 Fülle einen Ballon. Ein Ballon ist so konstruiert, dass er durch Gas aufgeblasen wird, was ihn zum perfekten Gefäß für die Speicherung einer bestimmten Menge an Gas macht. Sie können den Ballon mit Luft mit einer Pumpe füllen, oder Sie können eine andere Art von Gas wie Helium oder Stickstoff wählen. Sobald der Ballon gefüllt ist, binden Sie das Ende ab, so dass kein Gas entweicht.[1]  2 Tauchen Sie den Ballon vollständig in einen durchsichtigen Behälter. Als nächstes tauchen Sie den Ballon in einen Behälter mit Wasser. Der Ballon wird den Wasserstand ansteigen lassen. Markieren Sie die neue Höhe des Wassers und entfernen Sie den Ballon.[2]
2 Tauchen Sie den Ballon vollständig in einen durchsichtigen Behälter. Als nächstes tauchen Sie den Ballon in einen Behälter mit Wasser. Der Ballon wird den Wasserstand ansteigen lassen. Markieren Sie die neue Höhe des Wassers und entfernen Sie den Ballon.[2]  3 Messen Sie die Menge des verdrängten Wassers. Verwenden Sie ein Messgerät (z. B. eine Tasse oder einen Becher), um die Wassermenge zu messen, die benötigt wird, um den Behälter bis zur Markierung zu füllen (ohne den Ballon im Wasser). Gieße langsam. Wenn Sie zu viel gießen, müssen Sie von vorne beginnen. Das Volumen des Ballons entspricht dem Volumen des Wassers, das Sie hinzufügen. Notieren Sie diesen Wert für die spätere Verwendung als V.[3]
3 Messen Sie die Menge des verdrängten Wassers. Verwenden Sie ein Messgerät (z. B. eine Tasse oder einen Becher), um die Wassermenge zu messen, die benötigt wird, um den Behälter bis zur Markierung zu füllen (ohne den Ballon im Wasser). Gieße langsam. Wenn Sie zu viel gießen, müssen Sie von vorne beginnen. Das Volumen des Ballons entspricht dem Volumen des Wassers, das Sie hinzufügen. Notieren Sie diesen Wert für die spätere Verwendung als V.[3]  4 Wiege den mit Gas gefüllten Ballon ab. Sie können den Ballon mit einer empfindlichen Waage wiegen. Elektrische Waagen sind normalerweise die besten für diese Anwendung. Notieren Sie das Gewicht des gasgefüllten Ballons für die spätere Verwendung als mGB.[4]
4 Wiege den mit Gas gefüllten Ballon ab. Sie können den Ballon mit einer empfindlichen Waage wiegen. Elektrische Waagen sind normalerweise die besten für diese Anwendung. Notieren Sie das Gewicht des gasgefüllten Ballons für die spätere Verwendung als mGB.[4]  5 Finde die Masse des leeren Ballons. Stechen Sie ein Loch in den Ballon. Dadurch kann das Gas entweichen. Wiegen Sie den Ballon erneut und notieren Sie das Gewicht des leeren Ballons als mB.[5]
5 Finde die Masse des leeren Ballons. Stechen Sie ein Loch in den Ballon. Dadurch kann das Gas entweichen. Wiegen Sie den Ballon erneut und notieren Sie das Gewicht des leeren Ballons als mB.[5] 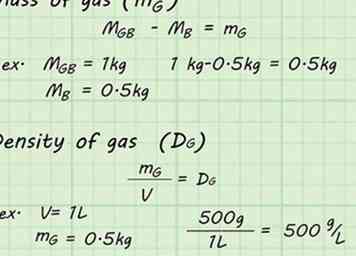 6 Mach die Berechnungen. Jetzt, da Sie genügend Daten haben, können Sie die Dichte des Gases im Ballon berechnen. Subtrahiere das Gewicht des leeren Ballons, mB, vom Gewicht des vollen Ballons, mGB. Dies gibt Ihnen die Masse des Gases allein, mG. Teilen Sie die Masse des Gases, mGdurch das Volumen V des Gases, um die Dichte des Gases zu finden, DG.[6]
6 Mach die Berechnungen. Jetzt, da Sie genügend Daten haben, können Sie die Dichte des Gases im Ballon berechnen. Subtrahiere das Gewicht des leeren Ballons, mB, vom Gewicht des vollen Ballons, mGB. Dies gibt Ihnen die Masse des Gases allein, mG. Teilen Sie die Masse des Gases, mGdurch das Volumen V des Gases, um die Dichte des Gases zu finden, DG.[6]  1 Verstehen Sie das ideale Gasgesetz. Sie sollten wissen, dass das Idealgasgesetz ein theoretisches Werkzeug ist, das das Verhalten von Gasen unter bestimmten Bedingungen bestimmt. Sie können es in der Gleichung PV = nRT zusammenfassen. Das bedeutet einfach, dass der Druck (P) multipliziert mit dem Volumen (V) gleich der Anzahl der Mole (n) mal der idealen Gaskonstante (R) multipliziert mit der absoluten Temperatur (T) für ein ideales Gas ist. [7]
1 Verstehen Sie das ideale Gasgesetz. Sie sollten wissen, dass das Idealgasgesetz ein theoretisches Werkzeug ist, das das Verhalten von Gasen unter bestimmten Bedingungen bestimmt. Sie können es in der Gleichung PV = nRT zusammenfassen. Das bedeutet einfach, dass der Druck (P) multipliziert mit dem Volumen (V) gleich der Anzahl der Mole (n) mal der idealen Gaskonstante (R) multipliziert mit der absoluten Temperatur (T) für ein ideales Gas ist. [7]  2 Angenommen, Standardtemperatur und -druck. Standardtemperatur und -druck oder STP sind als 273 K (32 ° F) (0 ° C) und 1 Standardatmosphäre (1,0 bar) definiert. Angenommen, STP ermöglicht es Ihnen, das Volumen von 1 Mol eines beliebigen Gases auf 22,414 Liter zu berechnen. Die Kenntnis dieses Volumens ist unerlässlich, um die Dichte Ihres Gases zu finden.[8]
2 Angenommen, Standardtemperatur und -druck. Standardtemperatur und -druck oder STP sind als 273 K (32 ° F) (0 ° C) und 1 Standardatmosphäre (1,0 bar) definiert. Angenommen, STP ermöglicht es Ihnen, das Volumen von 1 Mol eines beliebigen Gases auf 22,414 Liter zu berechnen. Die Kenntnis dieses Volumens ist unerlässlich, um die Dichte Ihres Gases zu finden.[8] 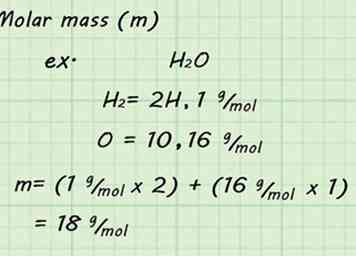 3 Finde die molare Masse des Gases. Da Sie STP verwenden und ein Mol Gas annehmen, ist das Auffinden der Molmasse einfach. Addiere die Molmasse aller einzelnen Atome, aus denen du Gas hast, um die Molmasse des Gases zu finden. Die atomaren Massen können im Periodensystem gefunden werden.[9]
3 Finde die molare Masse des Gases. Da Sie STP verwenden und ein Mol Gas annehmen, ist das Auffinden der Molmasse einfach. Addiere die Molmasse aller einzelnen Atome, aus denen du Gas hast, um die Molmasse des Gases zu finden. Die atomaren Massen können im Periodensystem gefunden werden.[9] 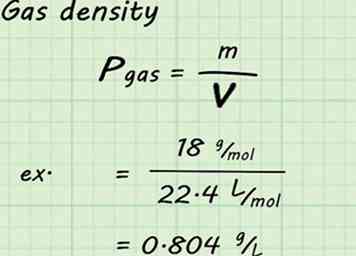 4 Berechnen Sie die Dichte des Gases. Obwohl das Volumen und die Mole von Gas in diesen Berechnungen fixiert sind, ist die Molmasse für jedes Gas unterschiedlich. Das bedeutet, dass die Dichte für jedes Gas unterschiedlich ist. Um eine gegebene Gasdichte zu finden, teilen Sie die Molmasse des Gases durch das Molvolumen (in diesem Fall 22,4 L / mol).[10]
4 Berechnen Sie die Dichte des Gases. Obwohl das Volumen und die Mole von Gas in diesen Berechnungen fixiert sind, ist die Molmasse für jedes Gas unterschiedlich. Das bedeutet, dass die Dichte für jedes Gas unterschiedlich ist. Um eine gegebene Gasdichte zu finden, teilen Sie die Molmasse des Gases durch das Molvolumen (in diesem Fall 22,4 L / mol).[10] 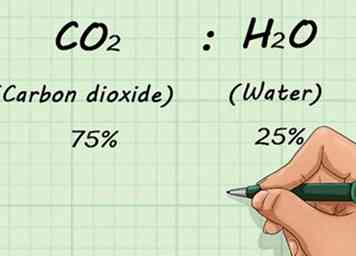 1 Kenne den fraktionellen Abbau des Gasgemisches. Wenn Sie zwei oder mehr Gase gemischt haben, müssen Sie wissen, wie viel von jedem Gas vorhanden ist. Dies geschieht prozentual. Dadurch können Sie die Verhältnisse der Mischung unabhängig davon, wie viel Gas insgesamt vorhanden ist, kennen.[11]
1 Kenne den fraktionellen Abbau des Gasgemisches. Wenn Sie zwei oder mehr Gase gemischt haben, müssen Sie wissen, wie viel von jedem Gas vorhanden ist. Dies geschieht prozentual. Dadurch können Sie die Verhältnisse der Mischung unabhängig davon, wie viel Gas insgesamt vorhanden ist, kennen.[11]  2 Finde die Masse von einem Maulwurf. Wenn Sie das Verhältnis Ihrer Gase kennen, können Sie die Molmasse Ihrer Mischung finden. Sie müssen die Molmasse jedes Gases finden und es mit seiner prozentualen Zusammensetzung in der Mischung multiplizieren. Dann füge alle Produkte zusammen, um die Molmasse des Gasgemisches zu finden.[12]
2 Finde die Masse von einem Maulwurf. Wenn Sie das Verhältnis Ihrer Gase kennen, können Sie die Molmasse Ihrer Mischung finden. Sie müssen die Molmasse jedes Gases finden und es mit seiner prozentualen Zusammensetzung in der Mischung multiplizieren. Dann füge alle Produkte zusammen, um die Molmasse des Gasgemisches zu finden.[12] 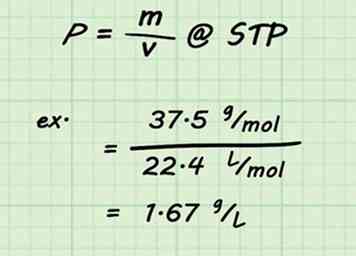 3 Teile durch das Volumen. Sobald die Molmasse für Ihre Mischung festgelegt wurde, ist die Ermittlung der Dichte des Gases eine einfache Berechnung. Teilen Sie die Molmasse durch das Standardvolumen (22,4 L / mol). Denken Sie daran, dass Sie STP und 1 Mol Gas annehmen.[13]
3 Teile durch das Volumen. Sobald die Molmasse für Ihre Mischung festgelegt wurde, ist die Ermittlung der Dichte des Gases eine einfache Berechnung. Teilen Sie die Molmasse durch das Standardvolumen (22,4 L / mol). Denken Sie daran, dass Sie STP und 1 Mol Gas annehmen.[13]